Aller plus loin
Eux, petits et résistants !
Dans ce panneau, le sujet abordé est une nouvelle fois l’adaptation des bactéries à leur environnement, comment elles évoluent pour résister et survivre ! Nous allons vous expliquer le rôle des métaux dans la vie des bactéries et prendre l’exemple des infections par des mycoplasmes. L’équipe MycoMet étudie le mécanisme d’acquisition des métaux chez les mycoplasmes.
Le rôle des métaux
Les métaux sont essentiels à tous les êtres vivants afin d’accomplir des processus métaboliques essentiels. Cependant, les métaux peuvent également être toxiques à trop forte concentration, notamment en générant des radicaux libres qui endommagent la cellule. En raison de cette dualité, les organismes vivants possèdent des mécanismes dédiés au maintien de l’homéostasie cellulaire des métaux, impliquant une variété de protéines telles que des transporteurs membranaires, des régulateurs, des systèmes de trafic et de stockage. Les métaux jouent également un rôle central dans la lutte entre les agents pathogènes et l’hôte. L’une des réponses du système immunitaire de l’hôte consiste à limiter l’accès aux métaux essentiels, afin d’affamer les microorganismes pathogènes, un processus appelé « immunité nutritionnelle ». Pour contrer l’immunité nutritionnelle, les microbes ont développé des stratégies vitales pour acquérir des métaux nécessaires à leur survie à partir des cellules et des tissus qu’ils infectent. Ces systèmes d’acquisition des métaux représentent donc des cibles médicamenteuses intéressantes pour combattre les agents pathogènes humains.
L’exemple des mycoplasmes
Certaines bactéries du genre Mycoplasma (ou « mycoplasmes »), telles que Mycoplasma genitalium et Mycoplasma pneumoniae, infectent l’être humain. M. genitalium est responsable d’infection sexuellement transmissible (IST). La prévalence de M. genitalium dans la population générale est estimée autour de 1 à 3%. Ce pathogène provoque des urétrites chez l’homme et il est associé à des syndromes inflammatoires de l’appareil reproducteur chez la femme, ainsi qu’à des naissances prématurées. M. pneumoniae cause des infections respiratoires aiguës entraînant des centaines de milliers d’hospitalisations dans le monde chaque année.
La résistance aux antibiotiques est l’une des principales menaces pour la santé mondiale reconnue par l’Organisation Mondiale de la Santé (OMS) et constitue un problème préoccupant dans le cas des mycoplasmes. Les traitements de première intention sont des antibiotiques à large spectre, tels que les macrolides qui inhibent la synthèse des protéines ou les quinolones qui ciblent la réplication de l’ADN. Il est frappant de constater que les taux de résistance aux macrolides pour M. pneumoniae sont de plus en plus élevés, atteignant 100% dans certaines régions du monde, et déclenchant de fréquentes épidémies. De même, la prévalence des souches de M. genitalium résistantes aux antibiotiques augmente rapidement dans le monde entier. Cette émergence alarmante de la résistance aux antibiotiques chez les mycoplasmes exige que de nouvelles options thérapeutiques soient étudiées.
Nos travaux de recherche sur l’acquisition des métaux chez les mycoplasmes
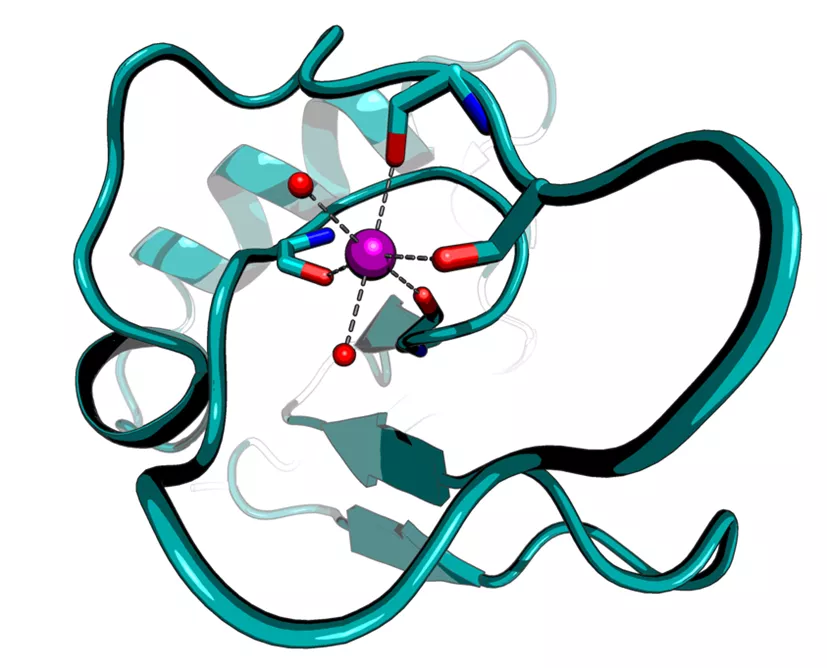
L’équipe MycoMet (https://cbi-toulouse.fr/fr/equipe-mycomet) étudie les protéines impliquées dans l’acquisition des métaux chez les mycoplasmes car ces protéines pourraient représenter des cibles thérapeutiques prometteuses et innovantes pour combattre l’antibiorésistance des mycoplasmes. Dans ce projet de recherche, nous utilisons notamment la méthode de cristallographie aux rayons X des protéines, pour laquelle il est nécessaire de purifier puis de cristalliser la protéine d’intérêt (voir figure 1). Cette approche va ensuite nous permettre de révéler la structure tridimensionnelle de cette protéine et ainsi comprendre comment elle fonctionne à un niveau atomique (voir figure 2). Ceci représente une étape cruciale dans la recherche de nouveaux médicaments qui pourraient cibler cette protéine.
Figure 1. Cristaux de protéine dans une goutte de cristallisation de 4 µl.
Figure 2. Structure tridimensionnelle d’une protéine (représentée en vert) en interaction avec un métal (en violet).
Méthode de préparation des échantillons pour cristallisation :
La protéine d’intérêt a été purifiée, c’est-à-dire qu’elle a été isolée du reste des composants des cellules bactériennes. Cette protéine est transférée dans une solution tampon qui permet son stockage de manière stable à une concentration de 20 mg/ml. Un volume de 2 µl de cette solution protéique est prélevé pour être déposé en goutte sur une lamelle de verre siliconée de 2 cm de diamètre. Elle est alors mélangée à 2 µl d’une solution de cristallisation contenant différents réactifs qui vont permettre la cristallisation de la protéine (la composition exacte de cette solution de cristallisation a été préalablement déterminée par l’utilisation de cribles de plusieurs centaines de conditions). La lamelle sur laquelle est déposée la goutte du mélange protéine et solution de cristallisation est ensuite retournée pour être scellée hermétiquement sur un puit de 1,6 cm de diamètre dont le réservoir contient 300 µl de solution de cristallisation. La goutte est ainsi suspendue dans un environnement clos, ce qui va permettre une diffusion de vapeur entre cette goutte et la solution du réservoir. Cette préparation est incubée à 22°C et la goutte est régulièrement observée via une loupe binoculaire afin de suivre l’apparition de cristaux de protéine. Après plusieurs jours d’incubation, la protéine a cristallisé en formant de nombreuses et longues aiguilles qui ressemblent à un oursin de mer. Ces cristaux de protéine vont pouvoir être prélevés et analysés par la méthode de cristallographie des rayons X afin d’obtenir la structure tridimensionnelle de la protéine.
Références bibliographiques :