Frise de Microscopie
Un peu d’histoire, ou l’évolution de la technologie au service de la microbiologie à travers des dates importantes.
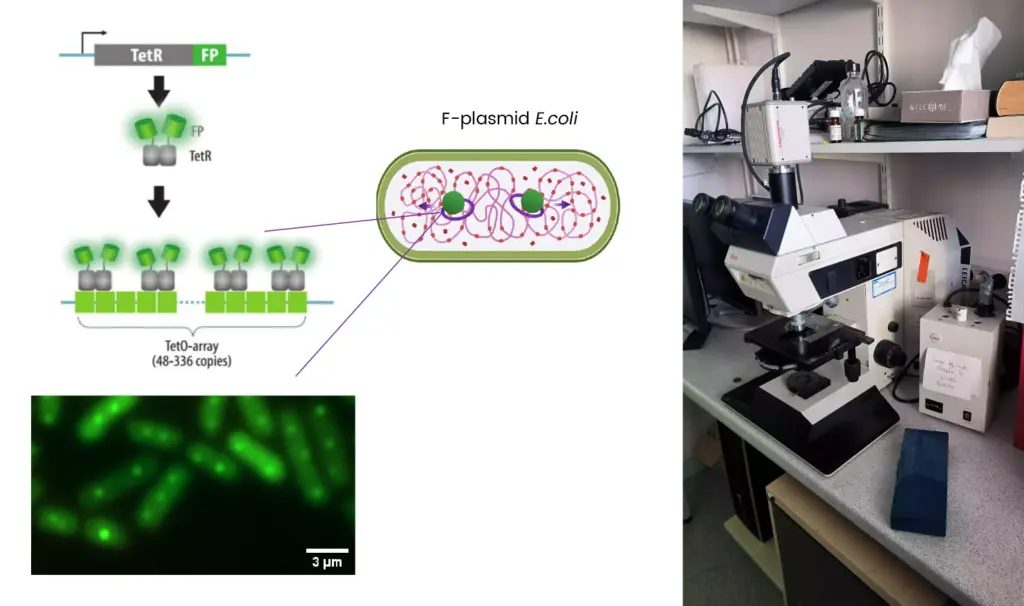
1993 - Leitz
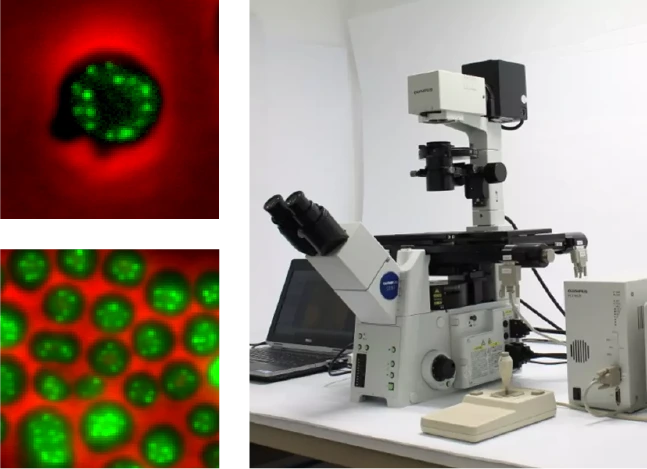
2006 - Olympus
Le principe est basé sur des galvanomètres à double balayage utilisant des filtres d’interférence pour la sélection de la longueur d’onde. La lumière de la lampe à arc au xénon est focalisée sur le premier miroir du galvanomètre qui la dirige, via un miroir parabolique, à travers l’un des canaux du filtre d’interférence. Après le filtre, un second miroir parabolique et un second miroir galvanométrique recueillent et redirigent la lumière dans le guide de lumière
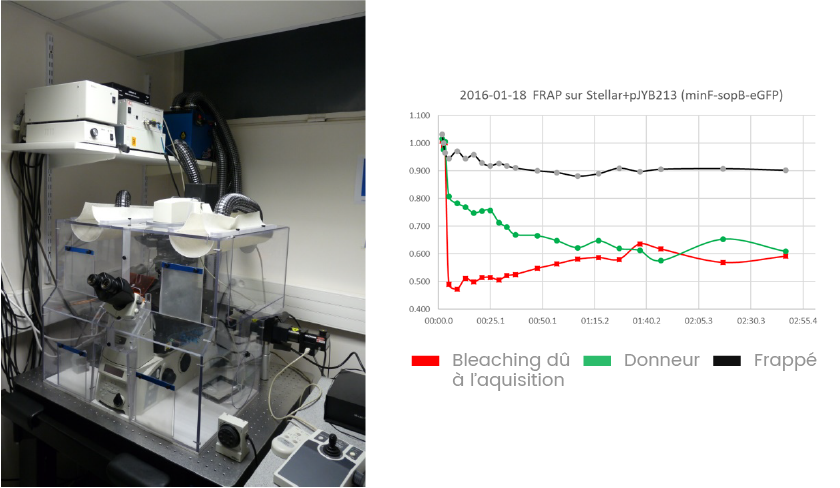
2011 - Nikon 1
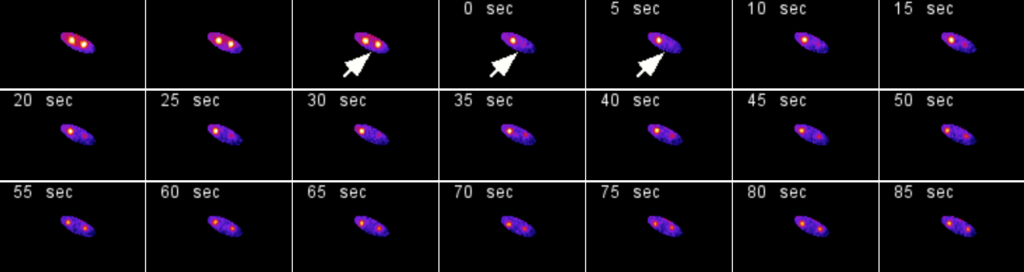
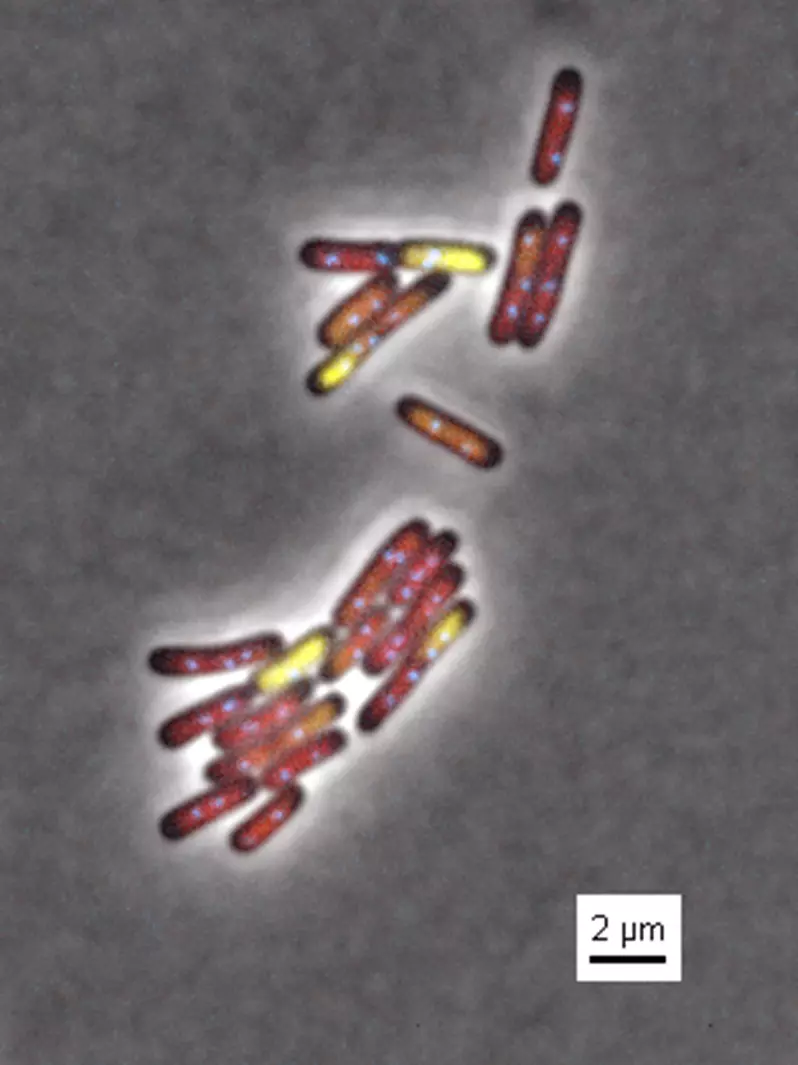
2016 - Nikon 2
Microscope dédié à la « microfluidique » équipé de lampes LEDs. Les LED produisent très peu de chaleur, ce qui les rend efficaces sur le plan énergétique et en fait un bon choix pour les spécimens sensibles à la température. En outre, la température de couleur est très faible, ce qui signifie que vous pouvez observer vos spécimens dans des couleurs aussi proches que possible de la réalité.