Escherichia coli : organisme modèle de laboratoire
Escherichia coli : au cœur de la matriX !
Le chromosome d’Escherichia coli contient l’équivalent de 1,2 octet de données. Tu as donc l’équivalent de 60 téraoctets (To) de données dans ton intestin.
Catherine Turlan, ingénieure de recherche : Catherine.Turlan@univ-tlse3.fr Service SIG : https://cbi-toulouse.fr/fr/equipe-service-ingenierie-genetique
Crédits photos : ©Violette Morales
Escherichia coli Famille : Enterobacteriaceae Forme : bâtonnet Type : Gram négatif Découverte : en 1885, par Theodor Escherich Adresse : tube digestif Spécificité : bactérie commensale dont la plupart des souches sont inoffensives, celles produisant des shigatoxines sont pathogènes. Pathologies : gastroentérite, infection urinaire, méningite ou sepsis
Explications
Tout microorganisme, aussi minimaliste soit-il, met en œuvre de multiples et complexes processus biologiques pour assurer sa survie, sa multiplication, mais aussi son adaptation aux conditions environnementales. Ces processus dépendent des protéines codées par le génome, le chromosome et éventuellement les plasmides, qui constitue le patrimoine génétique de chaque souche bactérienne.
Afin de caractériser la fonction de chaque protéine et de comprendre dans quel processus biologique elle est impliquée (ex : virulence, compétence, voie métabolique), un large éventail de méthodologies d’ingénierie génétique, de la génétique classique (à partir d’un phénotype mutant donné, identification du ou des gènes responsables) à la génétique inverse (comprendre la fonction de gènes d’intérêt par l’observation des mutants correspondants), peuvent être mises en œuvre.
La modification « à façon » de chaque génome et/ou de son expression permet d’accéder aux mécanismes physiologiques intracellulaires, intercellulaires, et d’interaction avec les cellules hôtes dans le cas des bactéries pathogènes.
L’ingénierie génétique microbienne est à l’origine de l’avènement de la biologie de synthèse qui s’attache à concevoir et à construire de nouveaux systèmes ou de nouvelles fonctions biologiques dans les bactéries. Elle est particulièrement développée dans le cadre de l’ingénierie métabolique qui utilise les techniques de génétique moléculaire pour reprogrammer les réseaux métaboliques d’une cellule vivante, dans le but de lui faire produire une substance d’intérêt (par exemple l’hormone de croissance) ou de l’ingénierie de bioremédiation qui permet d’améliorer les capacités de décontamination de certaines bactéries (voir panneau Titans).
Enfin, la « chirurgie génomique » est cruciale pour la compréhension des mécanismes de virulence et d’acquisition de résistances multiples aux antibiotiques, problématiques de santé majeures à ce jour.
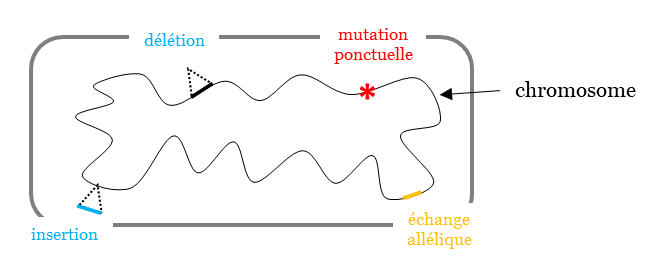
Développement de deux types d’ingénierie de génétique bactérienne :
Les protéines synthétisées seront modifiées :
✓ en délétant (enlevant) ou insérant des gènes
✓ en modifiant spécifiquement les gènes d’intérêt (mutation, échange allélique)
✓ de façon permanente et héréditaire
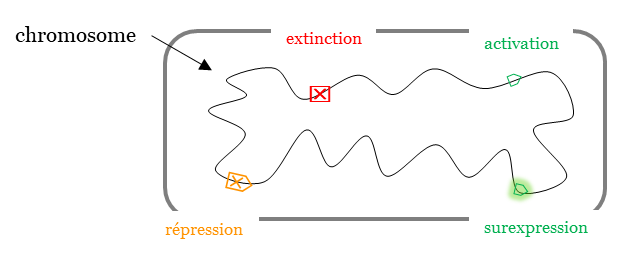
Ces modifications caractérisées d’ « épigénétique », permettent de comprendre les mécanismes modifiant de manière réversible, transmissible et adaptative l’expression des gènes sans en changer la séquence nucléotidique.
La quantité de chaque protéine est modulée :
✓ négativement (répression) ou positivement (activation)
✓ de façon inductible ou réversible
✓ en régulant la transcription du gène correspondant
Ce type de méthodologies permet d’étudier le phénotype (traits observables) associé aux modifications réalisées sur le ou les gènes d’intérêt. Il permet également de créer des souches (lignées) bactériennes présentant de nouvelles caractéristiques ou propriétés.
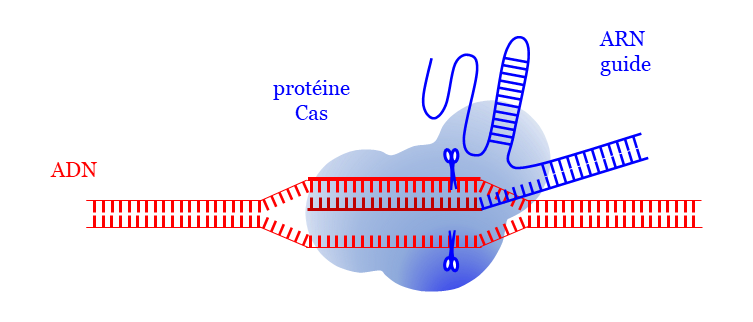
Développement de technologies dérivées des systèmes CRISPR-Cas
Il s’agit d’un système initialement caractérisé comme un système d’« immunité » des bactéries contre les phages ou les plasmides invasifs, qui a été « domestiqué » et est utilisé en tant qu’outil d’ingénierie génétique chez tous les organismes (bactéries, archées, eucaryotes).
Cette découverte des « ciseaux moléculaires » CRISPR-Cas9, a été récompensée du prix Nobel de chimie 2020 attribué à Emmanuelle Charpentier et Jennifer Doudna.
Il s’agit d’un outil :
✓ simple car il implique une seule protéine, la protéine Cas, et un ARN guide (gRNA)
✓ précis car il permet de cibler au nucléotide près
✓ universel car possibilité de ciblage de n’importe quelle séquence de 20 nts
Au LMGM-CBI, un service d’ingénierie génétique conseille et offre ses services au équipes de recherche de l’unité, de l’institut ou aux équipes extérieures.