Adaptation des bactéries à leur milieu / environnement
Quand les bactéries se transforment...
Escherichia coli peut parcourir 25 fois sa propre longueur en une seconde, ce qui équivaut à un cheval courant à 220km/h.
Personnes contact :
Nathalie Campo, Chercheure CNRS : nathalie.campo@univ-tlse3.fr
Patrice Polard, Directeur de Recherche CNRS : patrice.polard@univ-tlse3.fr
Visualisation virtuelle par microscopie de la cinétique de synthèse du peptidoglycane chez Streptococcus pneumoniae.
Les cellules de Streptococcus pneumoniae ont été incubées successivement avec plusieurs marqueurs fluorescent spécifiques d’une composante de l’enveloppe cellulaire, la paroi (HADA, bleu ; TADA, rouge ; NADA, vert). Le marquage permet de visualiser la synthèse de l’élément majeur de cette paroi, le peptidoglycane.
Crédits photos : ©Nathalie Campo
Les bactéries présentes dans tous les écosystèmes, possèdent une capacité remarquable d’adaptation rapide à leur environnement en échangeant et combinant des gènes. Au LMGM-CBI, l’équipe compétence et transformation du pneumocoque étudie les mécanismes qui permettent ces adaptations chez Streptococcus pneumoniae. dont une conséquence inquiétante est l’apparition récente de bactéries infectieuses résistantes à de multiples antibiotiques.
L’évolution des êtres vivants se fait par deux voies principales : par mutations survenant aléatoirement dans l’ADN de leur génome et par le brassage de leurs gènes. Chez l’homme, cette recombinaison génétique se produit lors de la reproduction sexuée. Elle implique le mélange de la moitié du patrimoine génétique du père et de la mère, conduisant ainsi à des enfants aux caractères différents.
Les bactéries échangent également leurs gènes mais de manière très différente, en mobilisant différents mécanismes de transfert latéral d’ADN communément qualifiés de transfert horizontal de gènes. Ce mode de brassage génétique est à la base de l’extraordinaire diversité du monde bactérien. Son étude a conduit à la notion de ‘pangénome’ de chaque espèce bactérienne. Par exemple, le patrimoine génétique de chaque souche d’Escherichia coli est composé d’environ 4 500 gènes parmi un ensemble d’au moins 15 000 gènes, un pangénome formant un potentiel de recombinaisons quasi infini. Ainsi, ces pangénomes bactériens sont des sources reconnues d’émergence de résistances aux antibiotiques et de stratégies échappatoires aux vaccins pour de nombreuses espèces pathogènes.
Streptococcus pneumoniae, micro-organisme unicellulaire, a la capacité de chercher et intégrer des gènes extérieurs, provenant d’autres bactéries, dans son propre génome (Johnston et al., 2014a). Il effectue cette opération en réaction par exemple à un stress, comme la présence d’antibiotiques (Prudhomme et al., 2006).
Sur toute une population de pneumocoques qui effectuent cette « transformation génétique », certains individus récupèrent des fragments d’ADN intéressants qui lui donnent un avantage pour s’adapter à un nouvel environnement. En présence d’un stress particulier, ne subsisteront alors que les individus modifiés résistants à ce stress (par exemple les antibiotiques).
La capacité à effectuer cette « transformation génétique » est permise par l’expression transitoire de gènes précis (Dagkessamanskaia et al., 2004; Weyder et al., 2018; Johnston et al., 2020), sous forme de protéines (Claverys et al., 2009).
L’équipe compétence et transformation du pneumocoque étudie sur le plan fondamental ce mécanisme particulier d’échanges de gènes appelé « transformation naturelle », avec pour objectif de retrouver quels sont les gènes et protéines acteurs de la transformation et de visualiser sous le microscope son exécution dans des cellules vivantes du pneumocoque. Ce défi expérimental a mobilisé l’utilisation de microscopes de dernière génération (voir frise de la microscopie) et la capacité à modifier et tracer en temps réel par fluorescence ces mécanismes au niveau de cellules individuelles.
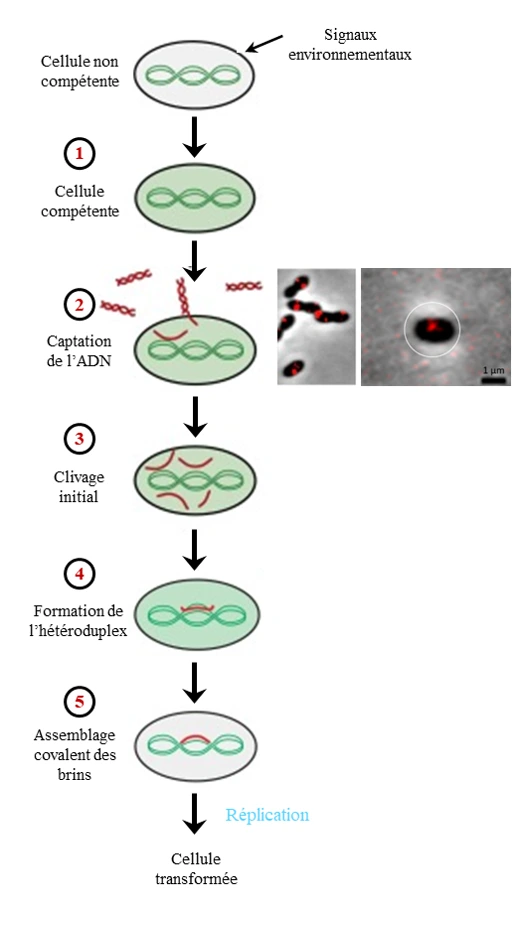
Transformation naturelle du pneumocoque.
Des signaux environnementaux peuvent déclencher l’apparition de la compétence naturelle dans une cellule de pneumocoque. Une fois compétentes, les cellules peuvent capturer de l’ADN étranger. Cet ADN est capturé au milieu de la cellule (foci rouges). Après avoir été capturé, l’ADN est transféré à une nucléase (protéine qui dégrade l’ADN) qui va dégrader un brin de l’ADN capturé. L’ADN simple brin restant est transféré à travers la membrane dans le cytoplasme de la cellule. Après internalisation, l’ADN est recouvert de protéines qui vont le protéger d’autres nucléases. Il constitue alors un réservoir d’ADN et pourra être intégré dans le chromosome bactérien par recombinaison homologue.
Un exemple de détection directe de transfert horizontal au microscope. La transformation de L’ADN marqué en rouge permet ici la production d’une structure verte dans les cellules.