Adaptation des bactéries à leur milieu / environnement
Born to move !
Fun fact : Les bactéries sont capables de communiquer entre-elles à l’aide de signaux électriques.
Personne contact : Catherine Guynet, chargée de recherche : catherine.guynet@univ-tlse3.fr
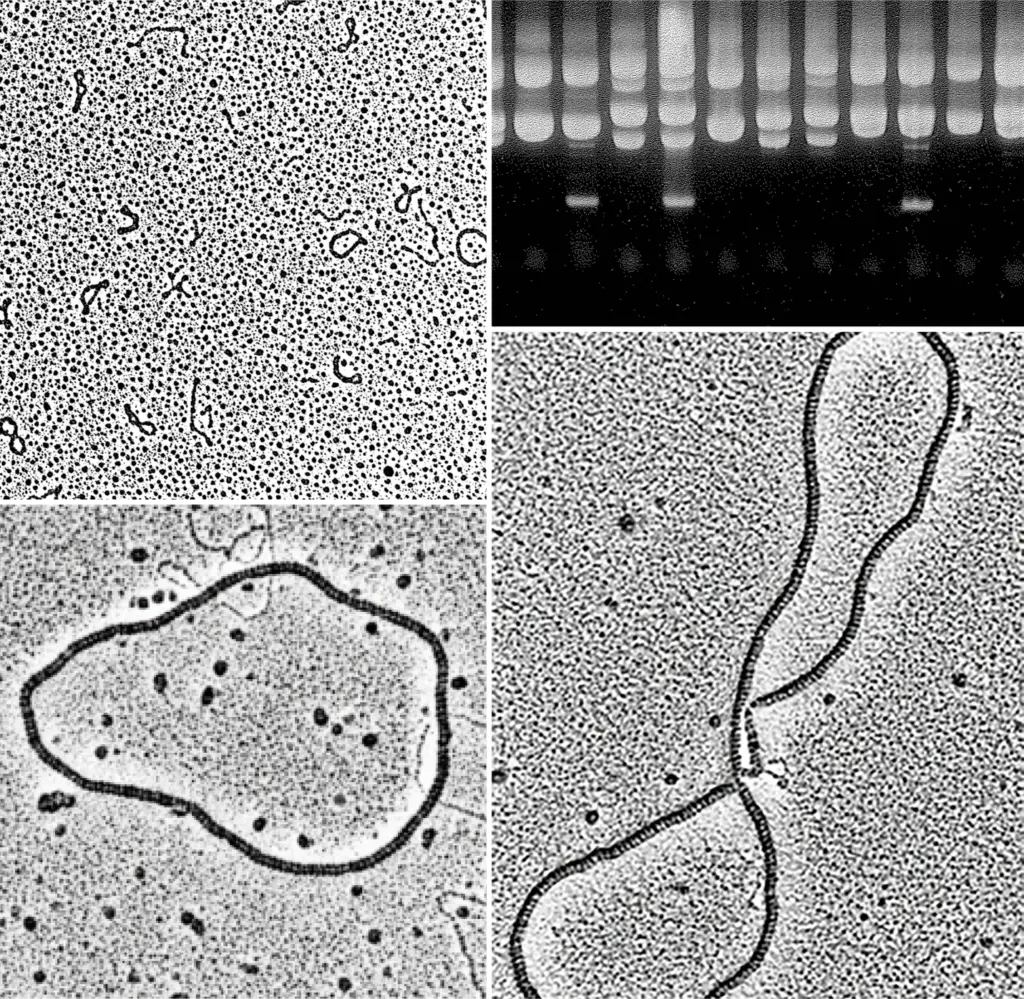
En haut à gauche : image de microscopie électronique représentant des séquences d’insertion (petits morceaux d’ADN qui codent pour une transposase, une enzyme qui permet leur propre mobilité) sous forme de huit et de cercles qui sont des intermédiaires de transposition.
En bas : les deux photos montrent des grossissements de la première.
En haut à droite : gel d’agarose de fragments d’ADN.
Crédits photos : ©Patrice Polard et ©David Villa

Escherichia coli
Famille : Enterobacteriaceae
Forme : bâtonnet
Type : Gram négatif
Découverte : en 1885, par Theodor Escherich
Adresse : tube digestif
Spécificité : bactérie commensale dont la plupart des souches sont inoffensives, celles produisant des shigatoxines sont pathogènes.
Pathologies : gastroentérite, infection urinaire, méningite ou sepsis
Explications
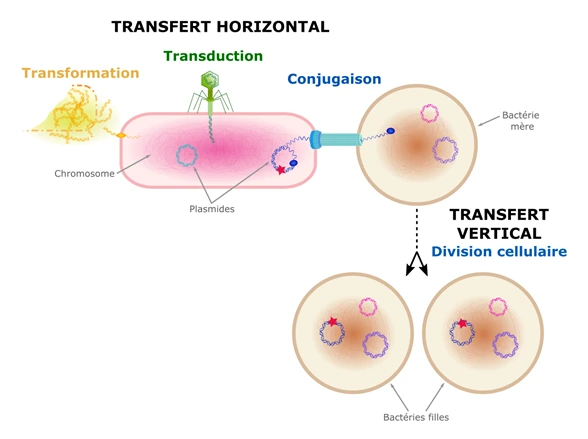
S’échanger du matériel génétique : le transfert horizontal de gènes !
Le transfert horizontal de gènes est possible grâce à différents mécanismes, selon la façon dont l’ADN est transféré. Il peut être capturé par les bactéries lorsqu’il se trouve dans le milieu extérieur (la transformation – voir panneau « Quand les bactéries se transforment … »), transmis par les virus bactériens appelés bactériophages (la transduction – voir panneau « Un Alien qui vous veut aussi du bien »), ou encore injecté par une bactérie dans une autre à l’aide d’une « seringue moléculaire » (la conjugaison).
Le sexe selon les bactéries : la conjugaison bactérienne
La conjugaison bactérienne correspond au transfert d’une molécule d’ADN appelée plasmide d’une bactérie donatrice ayant établi un contact avec une bactérie réceptrice. Le plasmide porte tous les gènes qui codent deux véritables petites machines moléculaires très sophistiquées nécessaires à son transfert : le relaxosome et le pilus de conjugaison, appelé aussi système de sécrétion de type 4. Le relaxosome prépare l’ADN à son transfert grâce à des protéines spécialisées capables de couper un des deux brins d’ADN et le conduire dans la bactérie réceptrice à travers le pilus. Celui-ci est composé de nombreuses protéines différentes qui s’assemblent au niveau de la membrane de la bactérie donatrice pour former une sorte de seringue.
Les plasmides conjugatifs sont des molécules d’ADN extra-chromosomiques qui se répliquent de façon autonome à côté du chromosome bactérien. Ils font partie du « mobilome », qui contient l’ensemble des « éléments génétiques mobiles » du génome des bactéries (EGMs). Le mobilome comprend aussi des petits « gènes sauteurs », les transposons et les intégrons, qui sont capables de se déplacer au sein du chromosome, mais aussi entre le chromosome et les plasmides. Les plasmides se comportent donc comme des cargos naturels d’EGMs, qui sont capables de disséminer les gènes à travers différentes espèces, genres, ordres et même phyla bactériens grâce à la conjugaison. Comme les EGMs portent la majorité des déterminants de résistance aux antibiotiques, les plasmides sont largement responsables de l’émergence de bactéries multirésistantes. De nombreuses études ont démontré leur impact considérable sur la dissémination des gènes de résistance aux antibiotiques, en particulier chez les pathogènes humains bien étudiés.
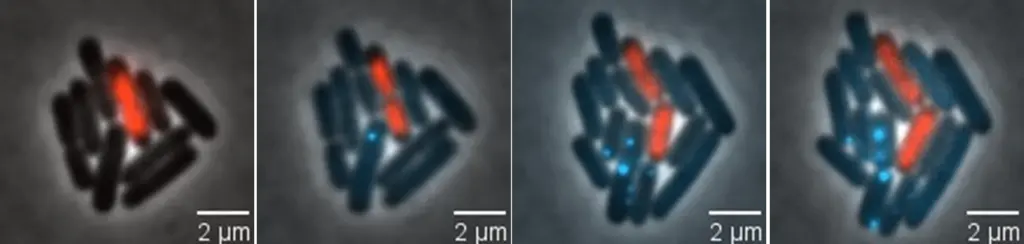
Etude des plasmides au laboratoire
Au laboratoire, nous étudions la dynamique des plasmides, afin de mieux comprendre quand, où et comment ils se propagent et comment tout cela est régulé. Grâce aux techniques de marquage fluorescent des protéines dans des bactéries vivantes et aux dernières générations de microscopes, nous pouvons visualiser les étapes de la conjugaison en temps réel, ce qui est crucial pour leur compréhension. Ces connaissances pourraient contribuer à mieux contrôler la dissémination des gènes de résistance aux antibiotiques ainsi qu’à la mise au point de traitements antimicrobiens alternatifs aux antibiotiques. En effet, plusieurs travaux récents ont montré que la conjugaison pourrait être un outil prometteur pour délivrer des agents antibactériens et éliminer directement et spécifiquement des bactéries pathogènes cibles dans une population bactérienne.