Adaptation des bactéries à leur milieu / environnement
L’antidote à son poison !
Fun fact : On peut utiliser les bactéries pour produire des médicaments, l’exemple le plus connu étant la production d’insuline par Escherichia coli qui permet de soigner les diabétiques.
Personnes contact :
Patricia Bordes, Chercheure CNRS : patricia.bordes@univ-tlse3.fr
Pierre Genevaux, Chercheur CNRS : pierre.genevaux@univ-tlse3.fr
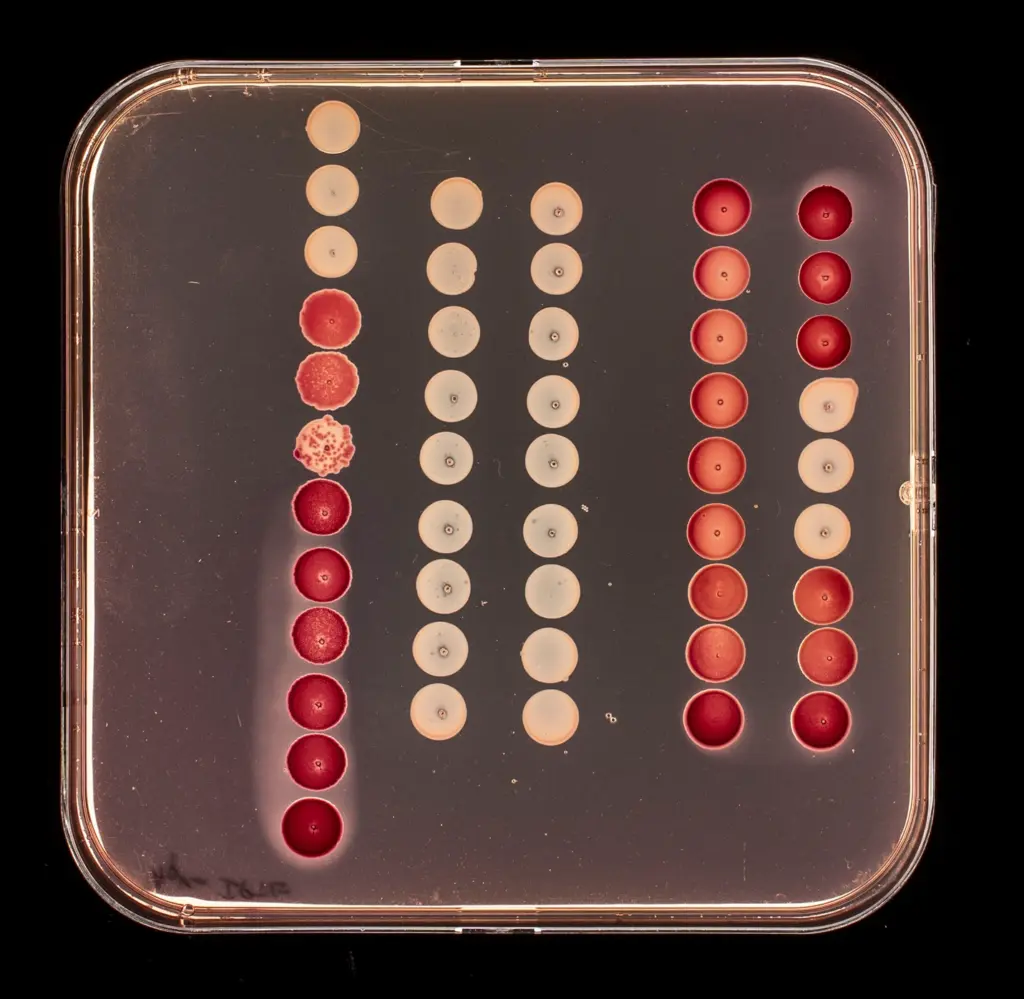
Détection des interactions entre deux protéines chez Escherichia coli.
Criblage des interactions protéine-protéine entre des toxines et leur cible intracellulaire par double hybride bactérien (BACTH) dans la souche d’Escherichia coli.
Une interaction positive est visualisée par une coloration plus ou moins rouge des colonies suite à la fermentation du maltose sur une boite de Petri contenant du milieu MacConkey Maltose. Les contrôles négatif (colonies blanches) correspondent aux plasmides exprimant T25 ou T18 seul (sans insert).
Crédits photos : ©Patricia Bordes & ©David Villa

Escherichia coli
Famille : Enterobacteriaceae
Forme : bâtonnet
Type : Gram négatif
Découverte : en 1885, par Theodor Escherich
Adresse : tube digestif
Spécificité : bactérie commensale dont la plupart des souches sont inoffensives, celles produisant des shigatoxines sont pathogènes.
Pathologies : gastroentérite, infection urinaire, méningite ou sepsis
Explications
Les systèmes toxine-antitoxine (TA) bactériens ont été découverts il y a une quarantaine d’années sur des plasmides, qui sont de petites molécules d’ADN circulaires distinctes du chromosome bactérien. Depuis, ils ont été identifiés chez la plupart des chromosomes bactériens, des éléments génétiques mobiles tels que les bactériophages ou virus tueurs de bactéries et les éléments transposables qui sont capables de se déplacer de manière autonome dans un génome, et aussi chez les archaea. Par exemple, la souche commune de laboratoire Escherichia coli K-12 héberge au moins 30 systèmes TA et Mycobacterium tuberculosis, l’agent responsable de la tuberculose, en possède plus de 80 (figure ci-dessous).
Les systèmes TA sont composés de deux gènes retrouvés l’un à côté de l’autre. Un code pour une molécule « poison » (la toxine) et l’autre pour l’« antidote » correspondant (l’antitoxine). Les toxines sont des protéines ou des ARN qui vont s’attaquer à des processus cellulaires vitaux pour la bactérie qui les héberge, de manière à entrainer un ralentissement de la croissance bactérienne (effet bactériostatique) ou même la mort cellulaire (effet bactéricide). Ainsi, les toxines peuvent affecter la traduction (qui est l’étape de décodage de l’information génétique contenue dans les ARN messagers pour assembler les acides aminés qui forment les protéines), la réplication de l’ADN essentielle à la transmission de l’information génétique aux cellules filles, ou encore la synthèse de la paroi, qui est un garant de l’intégrité cellulaire. Les antitoxines sont des protéines ou des ARN qui vont spécifiquement empêcher l’action néfaste de leur toxine associée. Plusieurs mécanismes d’inhibition ont été caractérisés, les plus répandus étant un blocage direct de l’activité de la toxine par la formation d’un complexe protéique avec l’antitoxine, et le masquage des signaux de traduction de la toxine de manière à empêcher sa production. A ce jour, la nature de chaque élément et le mode d’inhibition ont permis de classifier ces systèmes en huit types.
Les systèmes TA fonctionnent comme des bombes à retardement capables de causer la mort de la cellule qui les active. La signification d’un tel « suicide » reste débattue mais plusieurs équipes de recherche ont montré que les systèmes TA jouent un rôle dans :
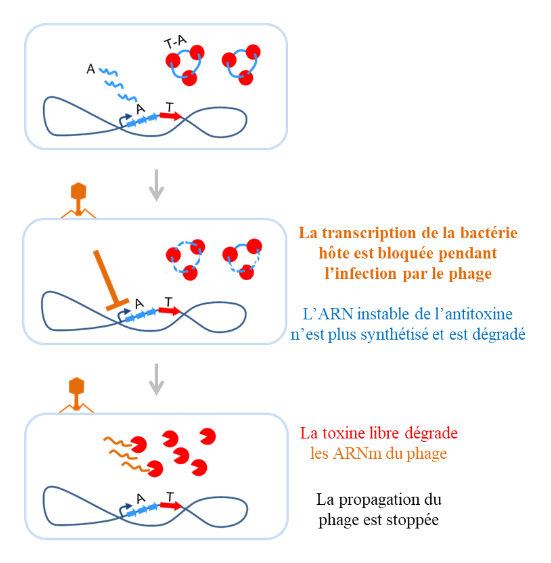
– la protection des bactéries contre l’infection par des phages. Par exemple, certaines attaques virales sont responsables du « sacrifice altruiste » d’une partie des bactéries après activation de leurs systèmes TA pour éliminer les bactéries infectées et empêcher la propagation des particules phagiques à leurs voisines, au profit du reste de la population. Ce mécanisme de défense bactérienne contre les phages fait partie du concept émergeant de « système immunitaire bactérien » qui permet de détecter et répondre à des signaux moléculaires déclencheurs spécifiques des phages.
– la stabilisation de régions génomiques. Par exemple, le premier système TA à avoir été découvert, le système ccdAB codé par le plasmide F de la bactérie Escherichia coli, est un module d’addiction qui rend les bactéries dépendantes de sa présence pour leur survie. En effet, si une cellule fille n’hérite pas du plasmide F après l’étape de division bactérienne, elle perd également les gènes ccdAB. Pour autant, les protéines CcdB (toxine) et CcdA (antitoxine) provenant de la cellule mère se retrouvent dans leur cytoplasme. L’antitoxine CcdA étant beaucoup plus instable que la toxine, elle sera dégradée beaucoup plus rapidement que la toxine, jusqu’à disparaitre. La toxine CcdB se retrouve alors libérée de l’emprise de CcdA et pourra remplir ses fonctions délétères pour entrainer la mort de la bactérie. Ce phénomène indispensable au maintien de certains plasmides (et de l’information génétique qu’ils contiennent) au sein d’une population bactérienne est aussi dénommé « tuerie post-ségrégationelle ».
– la virulence de bactéries pathogènes et la formation de « persisters », qui sont une sous-catégorie de bactéries capables de survivre aux traitements antibiotiques sans pour autant présenter de modification génétique pouvant être transmises aux cellules filles. En produisant des molécules toxiques pour les bactéries hôtes, les systèmes TA pourraient ralentir le métabolisme bactérien lors de l’adaptation aux stress rencontrés lors de la colonisation de l’hôte et dans la survie intracellulaire.
Les systèmes TA représentent un arsenal d’armes anti-microbiennes, qui pourraient être exploitées en biotechnologies pour développer de nouvelles stratégies de lutte contre les infections bactériennes. Plusieurs pistes ont été envisagées, par exemple en cherchant des molécules capables d’activer les toxines (par exemple en empêchant la formation d’un complexe TA), en caractérisant de nouveaux mécanismes d’inhibition par les toxines, ou encore en activant spécifiquement des toxines chez les bactéries pathogènes. Cela représente un enjeu majeur de santé publique du fait de l’émergence des multi-résistances aux antibiotiques qui rendent de nombreux antibiotiques inefficaces, même contre les infections les plus banales. Ces moyens de lutte sont cependant à manier avec précaution puisque, selon les toxines, leur activation peut tuer les bactéries ou les placer dans un état d’hibernation durant lequel elles peuvent devenir persistantes aux antibiotiques et ainsi aggraver les problématiques de résistance aux antibiotiques.
L’équipe “Proteostasis networks and translational control in bacteria” a caractérisé en particulier un des systèmes TA particulier de M. tuberculosis, le système de type II TAC.